1. Introduccion
2. Las sustancias
3.Metodos para Separar las Mezclas
4. Glosario
1. INTRODUCCIÓN
2. Las sustancias
3.Metodos para Separar las Mezclas
4. Glosario
1. INTRODUCCIÓN
Un objetivo de la QUÍMICA es el estudio de la materia. Decimos que la materia es todo lo que nos rodea, y que esta formada por mezclas de distintos materiales y que podemos separar y diferenciar por su comportamiento; lo cual se puede llamar SUSTANCIAS.
2. LAS SUSTANCIAS
Las sustancias es una parte de materia de la que esta formada un cuerpo. Con distintos materiales diferenciados por nombres. Las sustancias se pueden ser Puras o Mezclas :
Sustancias Puras: Estan compuestas por un sola clase de sustancia, se caracterizan por unas propiedades especifica y su composición es fija. Las sustancias puras no pueden separarse por métodos físicos. Se dividen en elementos o compuestos:
- Elemento: es una sustancia que por métodos químico se descompone en una sola sustancia no más sencilla que ella. Se representan mediante símbolos; los símbolos son en letra mayúscula como el Boro (B) y el Fósforo (P), pero en algunos casos hay una letra mayúscula con una minúscula como el Cobre (Cu) y el Litio (Li). En la tabla periódica se encuentran los elementos. Se pueden dividir en 3 grupos:
- Metaloides: también llamados semimetales. Sus propiedades son intermedias entre los metales y no metales. No es tan buen conductor de electricidad o calor. No es maleable ni dúctil.
- Metales: son maleables y dúctiles. Es un buen conductor de electricidad y calor. Tienen lustre y diversidad de colores. Tienden a oxidarsen cuando sufren una reacción química.
- No metales: son frágiles y muy quebradisos. Es un mal conductor de electricidad y de calor. No tienen lustre pero si tienen diversos colores.
Los de color verde son los metales, los de color azul son los metaloides y los de color amarillo son los no metales.
- Compuesto: Es una sustancia que por métodos químicos, se forma la combinacion de dos o mas sustancias o elementos. Se representan por medio de formulas; estas formulas son con los símbolos de los elementos que forman el compuesto.
Los compuestos se pueden dividir en 2 grupos:
- Compuestos Orgánicos: tienen al Carbono (C) como uno de sus principales elementos, pero también hay otros como el Oxígeno (O), Hidrógeno (H), Fósforo (F), Cloro (CL), Yodo (I) y nitrógeno (N). Son conductores de electricidad, son densos.
- Compuestos Inorgánicos: participan la mayoría de los elementos. Se divide en 6 grupos:
- Óxidos: es una combinacion del Oxigeno con un elemento. Pero no se puede combinar con los halógenos ni con los gases nobles. Se divide en 2 grupos:
- Óxidos Ácidos: se forman al combinar el Oxigeno con un No Metal. Se escribe primero el nombre del no metal y luego el oxigeno ( No Metal + Oxigeno ---> Oxido Ácido). Ejemplo: C4 + O2 (2-) à CO2 (anhídrido carbónico)
- Óxidos Básicos: se forma combinando el Oxigeno con un Metal. Se escribe primero el metal y luego el oxigeno (Metal + Oxigeno ---> Oxido Básico). Ejemplo: 2Ca2 + O2 (2-) à 2CaO (Óxido de Calcio)
- Bases: no reacciona con los metales, tiene un sabor amargo, al disolverse conduce corriente eléctrica, reacciona con los ácidos neutralizándolos, es irritante para la piel, sus átomos se rompen con facilidad.
- Ácidos: sus moléculas inician con el Hidrógeno. Reacciona con los metales, tiene un sabor ácido, es buen conductor de electricidad en disoluciones, reacciona con las bases formando sales, es corrosivo, produce quemaduras en la piel.Se divide en 2 grupos:
- Hidrácidos: se forman combinando un Hidrógeno con un No Metal.
- Oxacidos: se forman combinando el Oxigeno, el Hidrógeno y un No Metal.
- Sales: es la combinacion de un Hidrácido con un Hidroxido de esto resultan una sal binaria o haloidea (Hidrácido + Hidroxido ---> Sal Haloidea o Binaria + Agua)
De los Oxacidos se pueden crear 3 sales:
- Oxisales Neutras: Se sustituyen los Hidrógenos del Ácido como el nitrato de sodio
- Oxisales Acidas: se obtiene cuando la sustitucion del hidrógeno es parcial como el Hidrogenofosfato de potasio
K2HPO4
- Oxisales Complejas: se obtiene con la sustitucion del hidrógeno por 3 o mas metales diferentes, como el fosfato de calcio y potasio
- Hidruros: se combina el Hidrógeno con un Metal ( Metal + Hidrógeno --> Hidruro)
- Hidroxidos: se combina un Metal con Agua ( Metal + Agua ---> Hidróxido)
Mezclas: es la unión de sustancias en la que su estructura no cambia el ser mezclada, lo cual sus propiedades permanecen constantes y sus proporciones varían. Se pueden separar por procesos físicos. Se dividen en 2 grupos:
- Mezclas Homogeneas: también se llama soluciones o disoluciones, son uniformes, tiene sus propios métodos de separación, no se separan normalmente, tienen una sola fase y no se diferencian los componentes.
- Mezclas Heterogeneas: no son uniformes, tienen mas de una fase, se ven los componentes, tienen sus propios métodos de separación, se separan por si solos.
Las sustancias se presentan en 3 estados que son:
- Solido: tiene una forma fija y un volumen fijo:
- Liquido: tienen una forma variable (se adaptan al recipiente) y un volumen fijo.
- Gaseoso: tienen una forma variable (se adaptan al recipiente) y un volumen variable (ocupa todo el volumen del recipiente)
Las propiedades de las sustancias son 2, que son:
- Propiedades Generales o Extrínsecas: son las propiedades mas comunes, no nos dicen información de como se comporta una sustancia y como se distingue de las demás. Las mas importantes son:
- Masa: cantidad de materia que tiene un cuerpo
- Peso:la fuerza de atracción o gravedad que ejerce la tierra sobre un cuerpo.
- Volumen: espacio que ocupa un cuerpo
- Porosidad: consiste en presentar espacios vacios o poros
- Inercia: tendencia de de un cuerpo a permanecer en estado de reposo
- Inpenetrabilidad: un cuerpo no puede ocupar el espacio que ocupa otro cuerpo al mismo tiempo
- Propiedades Especificas o Intrinsecas: son caracteristicas de cada sustancia y permite diferenciarla de otro cuerpo. Se clasifican en fisicas y quimicas:
- Fisicas: se pueden determinar sin que los cuerpos varien su naturaleza. Entre estas se encuentra:
- Ductilidad: facilidad con que un cuerpo se transforma en hilo o alambre
- Elasticidad: capacidad con que un cuerpo se estira y vuelve a su forma inicial
- Dureza: resistencia de un cuerpo a ser rayado
- Densidad: relacion que existe entre la masa y el volumen
- Solubilidad: propiedad de un susancia de disolverse en un liquido a cierta temperatura
- Fragilidad: tendencia de un cuerpo a romperse o fracturarse
- Tenacidad: resistencia de un cuerpo a romperse o deformarse por los golpes
- Maleabilidad: capacidad de un cuerpo para transformarse en laminas
- Punto de ebullicion: sustancia que pasa de liquido a gaseoso por medio de la temperatura
- Punto de Fusion: sustancia que pasa del estado solido al gaseoso por medio de la temperatuta
- Quimicas: detrmina el comportamiento de una sustancia cuando se pone en contacto con otra.Algunas de estas son:
- Combustion: sustancia que al reaccionar con el oxigeno produce energia
- Reactividad con el Agua: metales que reaccionan violentamente con el agua y forman bases o hidroxidos
- Reactividad con las Sustancias Acidas: sustancias que reaccionan con los acidos
- Reactividad con las Bases: sustancias que reaccionan con las bases o hihidroxidos
Las sustancias tambien tienen transformaciones fisicas y quimicas, que son:
- Fisicas: son transformaciones que no afectan la composicion de la sustancia, no se forman nuevas sustancias. tambien son cambios fisicos los cambios de estado:
- Al aumentar la temperatura: las particulas de materia se mueven mas rapido y aumenta la fuerza de repulsion entre ellas
- Al aumentar la presion: las particulas de materia se acercan y aumenta las fuerza de cohesion entre ellas
Y tiene cambios de estado, que son:
- Fusion: pasar de liquido a solido
- Solidificacion: pasar de liquido a solido
- Vaporizacion: pasar de liquido a gas
- Condensacion: pasar de gas a liquido
- Sublimacion Progresiva: pasar de solido a gas, sin psas por el estado liquido
- Sublimacion Regresiva: pasar de gas a solido
- Quimicas: son transformaciones que afectan la composicion de la materia y crea nuevas sustancias
3. Metodos para Separar las Mezclas
- Tamizado: Consiste en separar partículas sólidas de acuerdo a su tamaño. Prácticamente es utilizar coladores de diferentes tamaños en los orificios. Es decir, los de orificios más grandes se encuentran en la parte superior y los más pequeños en la inferior. Los coladores reciben el nombre de tamiz y están elaborados en telas metálicas. Los granos más pequeños atraviesan el tamiz y los más grandes son retenidos.
- Levigacion: Consiste en pulverizar la mezcla sólida y tratarla luego con disolventes apropiados. Se utiliza una corriente de agua que arrastra los materiales más livianos a través de una mayor distancia, mientras que los más pesados se van depositando; de esta manera hay una separación de los componentes de acuerdo a lo pesado que sean.
- Imantacion: Se fundamenta en la propiedad de algunos materiales de ser atraídos por un imán. El campo magnético del imán genera una fuente atractora, que si es suficientemente grande, logra que los materiales se acercan a él. Para poder usar este método es necesario que uno de los componentes sea atraído y el resto no.
- Decantacion: Esta técnica se basa en la diferencia de densidades entre los dos componentes, que hace que dejándolos en reposo se separen quedando el más denso arriba y el más fluido abajo. Como casi siempre queda un poco de líquido en el sólido la separación se puede terminar por evaporación.
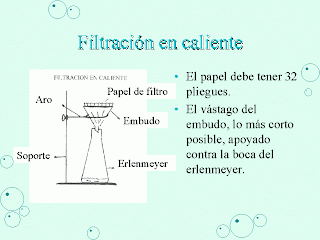
- Filtracion: Para separar estos componentes se pasa la mezcla porosa por un papel de filtro y de esta manera el sólido quedará en el papel y el líquido pasara por el filtro y lo traspasará. Se llama residuo lo que queda en el filtro, y filtrado lo que pasa a través del filtro.
- Centrifugacion: Es un procedimiento que se utiliza cuando se quiere acelerar la sedimentación. Se coloca la mezcla dentro de una centrifuga, la cual tiene un movimiento de rotación constante y rápido, lográndose que las partículas de mayor densidad, se vayan al fondo y las más livianas queden en la parte superior.
- Destilacion Simple: La destilación, como proceso, consta de dos fases: en la primera, el líquido pasa a vapor y en la segunda el vapor se condensa, pasando de nuevo a líquido en un matriz distinto al de destilación.Técnica que se utilizada para purificar un líquido o bien separar los líquidos de una mezcla líquida.
- Destilacion Fraccionada: Esta separación de mezcla se aplica para separar una mezcla de más de dos o más líquidos miscibles, los líquidos como condición deben de tener por lo menos 5º de diferencia del punto de ebullición. El liquido con el punto de ebullición mas bajo saldrá primero convertido en vapor, el cual se condensa al pasar por un refrigerante y se recoge en un recipiente.
- Cromatografia de Papel: Es un proceso en el cual se utiliza papel filtro, en el se coloca la mezcla que se va a separar y se pone en contacto con el disolvente. Una vez corrido el disolvente se retira el papel y se deja secar, se trata con un reactivo químico con el fin de poder revelar las manchas. Los distintos componentes se separan debido a que cada uno de ellos manifiesta diferentes afinidades por el papel filtro o por el disolvente.
- Cromatografia de Gases: En la cromatografía de gases, la mezcla, disuelta o no, es transportada por la primera especie química sobre la segunda, que se encuentran inmóvil formando un lecho o camino. Ambos materiales utilizarán las fuerzas de atracción disponibles, el fluido (transportados), para trasladarlos hasta el final del camino y el compuesto inmóvil para que se queden adheridos a su superficie.
- Cristalizacion: Este método se utiliza para separar una mezcla de sólidos que sean solubles en el mismo disolvente pero con curvas de solubilidad diferentes. Una vez que la mezcla esté disuelta, puede calentarse para evaporar parte de disolvente y así concentrar la disolución.
4. Glosario
Lustre: Brillo
Halógenos: Se dice de cada uno de los elementos de un grupo de la clasificación periódica, integrado por el flúor, cloro, bromo, yodo y el elemento radiactivo ástato, algunas de cuyas sales son muy comunes en la naturaleza.
Gases Nobles: Cada uno de los elementos químicos que, en condiciones normales, se encuentran en estado gaseoso.
Fuerza de Atracción: es cuando un objeto ejerce una fuerza sobre otro, y es atraído a este
Fuerza de Gravedad: es un fenómeno por el cual todos los objetos con una masa determinada se atraen entre ellos.
Reposo: Inmovilidad de un cuerpo cuando ocupa siempre la misma posición respecto a un sistema de referencia fijado.
Fuerza de Repulsión: es aquella que ocasiona que dos cuerpos al intentar acercarlos, los obliga a alejarse
Fuerza de Cohesión: Es la fuerza de atracción entre moléculas que mantiene unidas las partículas de una sustancia
Residuo: Material que queda como inservible después de haber realizado un trabajo u operación
Filtro: Cuerpo poroso o aparato a través de los cuales se hace pasar un liquido o un gas para eliminar las partículas sólidas en suspensión
Fluido: Sustancia cuyas moléculas tienen poca cohesión entre sí. Toma siempre la forma del recipiente que lo contiene.
Sedimentación: La sedimentación es el proceso por el cual el material sólido, transportado por una corriente de agua, se deposita en el fondo
Rotación: Movimiento de un cuerpo alrededor de un eje real o imaginario
Matriz: Se denomina matriz a una pieza normalizada de metal destinada a formar parte del molde de un tipo de imprenta
Purificar: Quitar las impurezas
Miscible: Capacidad de un compuesto líquido de formar mezclas con otro sin que se evidencien fases
Reactivo: toda sustancia que interactúa con otra
Pulverizar: Reducir a polvo una cosa
Disolvente: es una sustancia que permite la dispersión de otra en su seno
Tamiz: Colador